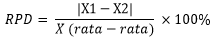Analisis Sediaan Farmasi
Analisis Kandungan Etanol dengan Metode Kromatografi Gas Detektor FID
Oleh :
Nama : Dinda Yulia Wahyuni Bahri
NIM : 18613114
Kelompok : C1
Program Studi Farmasi
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Islam Indonesia
2020
1. Dapat menjelaskan prinsip dasar pemisahan senyawa secara kromatografi gas dan aplikasinya.
2. Dapat menjelaskan alasan pemilihan metode kromatografi gas untuk analisis sampel
3. Dapat mempraktikkan analisis kualitatif dan kuantitatif kandungan alcohol dalam sampel
4. Dapat mempraktikkan teknik kuantifikasi standard internal
II. Alat dan Bahan
Alat
1. Labu takar 25 mL
2. Mikro pipet
3. Mikro syiring
4. Ultrasonicator
Bahan
1. Aquabides
2. Etanol pa
3. N-butanol pa
4. Sampel parfum
a. Pembuatan Kurva Baku
1.
Disiapkan larutan standar etanol
dengan berbagai konsentrasi, yaitu 2% ; 4% ; 6% ; 7% dan 8% menggunakan labu takar 25 mL. 2.
Kedalam masing-masing labu takar
ditambahkan 5.0 mL standar internal n-butanol. Lalu, ditambahkan akuabides hingga tanda batas. 3.
Sebanyak 1 miktoL larutan standard diinjeksikan
kedalam alat GC. Catat waktu retensi dan luas puncak komponen alcohol yang
dianalisis. 4.
Dari kromatogram yang dihasilkan,
buat kurva standar antara nisbah luas etanol denga luas propanol terhadap %
etanol. 5.
Tulis
perhitungan pengenceran pembuatan larutan seri kadarstandart etanol pada lembar
kerja | |||||||||||||
b. Preparasi dan Penetapan Kadar Sampel
1. Dipipet sampel yang diduga mengandung
etanol sebanyak 5 mL kedalam labu ukur 25 mL 2. Ditambahkan 5.0 mL standard internal
n-butanol.lalu, ditambahkan akuabides hingga tanda batas. 3. Sebanyak 1 μL larutan sampel
diinjeksikan kedalam alat GC. Catat waktu retensi dan luas puncak komponen
alcohol yang dianalisis 4. Hitung konsentrasi etanol dengan
menggunakan kurva standard. 5. Penetapan kadar sampel dilakukan
sebnayak 2x replikasi. Dihitung %RPD nya | |||||
c. Pembuatan Akurasi
1.
Dipipet
0.4 mL larutan standard etanol 10 %, masukkan kedalam labu takar 10 mL 2.
Ditambahkan
0.1 sampel parfum murni 3.
Ditambahkan
0.6 mL standard internal n-butanol 4. Ditambahkan akuades hingga tanda batas | |||
a. Pembuatan Kurva Baku
1. Disiapkan larutan standar etanol dengan berbagai konsentrasi, yaitu 0.2%, 0.4%, 0.6%, 0.8%,
1% menggunakan labu takar 10 mL. 2. Kedalam masing-masing labu takar ditambahkan 0.6 mL standar internal n-butanol. Lalu, ditambahkan akuabides hingga tanda batas. 3. Sebanyak 0.2 μL larutan standard diinjeksikan kedalam alat GC. Catat waktu retensi dan luas puncak komponen alcohol yang dianalisis. 4. Dari kromatogram yang dihasilkan, buat kurva standar antara nisbah luas etanol denga luas propanol terhadap % etanol. 5. Tulis perhitungan pengenceran pembuatan larutan seri kadarstandart etanol pada lembar kerja | |||||||||||||
b. Preparasi dan Penetapan Kadar Sampel
1. Dipipet sampel yang diduga mengandung etanol sebanyak 0.01 mL kedalam labu ukur 10 mL 2. Ditambahkan 0.6 mL standard internal n-butanol.lalu, ditambahkan akuabides hingga tanda batas. 3. Sebanyak 0.2 μL larutan sampel diinjeksikan kedalam alat GC. Catat waktu retensi dan luas puncak komponen alcohol yang dianalisis 4. Hitung konsentrasi etanol dengan menggunakan kurva standard. 5. Penetapan kadar sampel dilakukan sebnayak 2x replikasi. Dihitung %RPD nya | |||||
c. Pembuatan Akurasi
1. Dipipet 0.4 mL larutan standard etanol 10 %, masukkan kedalam labu takar 10 mL 2. Ditambahkan 0.1 sampel parfum murni 3. Ditambahkan 0.6 mL standard internal n-butanol 4. Ditambahkan akuades hingga tanda batas | |||
a. Pengenceran Etanol dari 100% ke 10% Dalam Labu Ukur 10 mL
M1 x V1 = M2 x V2
1005 x V1 = 10% x 10 mL
V1
= 1 mL
b.
Pengenceran Butanol
dari 100% ke 10% Dalam Labu Ukur 10 mL
M1 x V1 = M2 x V2
100% x V1 = 10% x 10 mL
V1 = 1 mL
c. Pengenceran Sampel Parfum (1000x Pengenceran) Dalam Labu 10 ml
= 10/1000
= 0.01
d. Perhitungan Konsentrasi Kurva Baku
· Konsentrasi 0.2%
M1 x V1 = M2 x V2
100% x V1 = 0.2% x 10 mL
V1
= 0.2 mL
·
Konsentrasi 0.4%
M1 x V1 = M2 x V2
100% x V1 = 0.4% x 10 mL
V1
= 0.4 mL
·
Konsentrasi 0.6%
M1 x V1 = M2 x V2
100% x V1 = 0.6% x 10 mL
V1
= 0.6 mL
·
Konsenntrasi 0.8%
M1 x V1 = M2 x V2
100% x V1 = 0.8% x 10 mL
V1
= 0.8 mL
·
Konsentrasi 1%
M1 x V1 = M2 x V2
100% x V1 = 1% x 10 mL
V1 = 1 mL
e. % RPD
= (1.0820596 – 0.905097)/0.99357 x
100%
= 17.81063 %
f.
Akurasi
= (0.6781 – 1.0598)/0.4376 x 100%
= 87.209987 %
1. Tabel Hasil Data
|
Nama |
RT Etanol |
LA Etanol |
RT Butanol |
LA Butanol |
Ratio (et/buta) |
|
0.2 |
0.65 |
463.6382 |
0.933 |
1288.8312 |
0.3597 |
|
0.4 |
0.656 |
620.9906 |
0.916 |
1418.9896 |
0.4376 |
|
0.6 |
0.64 |
462.5671 |
0.926 |
780.9832 |
0.5923 |
|
0.8 |
0.643 |
1510.2376 |
0.933 |
1938.9607 |
0.7789 |
|
1 |
0.646 |
1778.1026 |
0.93 |
1690.8802 |
1.0516 |
|
Sampel 1 (x1) |
0.646 |
2395.322 |
0.93 |
2260.2145 |
1.0598 |
|
Sampel 2 (x2) |
650 |
1565.5491 |
0.94 |
1725.7958 |
0.9071 |
|
Spike |
0.653 |
1762.6202 |
0.933 |
2599.273 |
0.6781 |
2. Grafik
|
kadar |
rasio (y) |
|
0.2 |
0.3597 |
|
0.4 |
0.4376 |
|
0.6 |
0.5923 |
|
0.8 |
0.7789 |
|
1 |
1.0516 |
Persamaan regresi linier → y = 0.8625x + 0.1265 → y = bx + a
R² = 0.9586
b = 0.8625
a = 0.1265
|
y (rasio) |
b |
a |
x(%) |
|
1.0598 |
0.8625 |
0.1265 |
1.0820596 |
|
0.9071 |
0.8625 |
0.1265 |
0.905097 |
|
Rata-rata |
0.9935783 |
||
|
%RPD |
17.81063 |
||
3. Akurasi
|
Nama |
Rasio (y) |
|
|
Spike |
0.6781 |
|
|
Sampel 1 |
1.0598 |
|
|
Sampel 2 |
0.9071 |
|
|
Standart |
0.4376 |
|
|
Akurasi sampel 1 (%) |
87.209987 |
|
|
Akurasi sampel 2 (%) |
52.333343 |
|
Berdasarkan perhitungan %RPD diperoleh nilai RPD sebesar 17.81063 %. Sedangkan menurut Standart Nasional Indonesia syarat keberterimaan RPD yairu ≤ 10% (Lusiana. L., 2012). Jadi nilai % RPD yang diperoleh tidak sesuai dengan literature, maka dapat disimpulkan bahwa data presisi tidak dapat diterima, hal tersebut kemungkinan disebakan karena kontaminasi bahan serta alat yang tidak steril dan kesalahan praktikan.
Berdasarkan dari grafik dperoleh nilai R² sebesar 0.9586. Sedangkan menurut literature nilai R² yang baik taitu mendekati 1 (Astuti. N. P. W, dkk., 2018). Jadi nilai R² dapat diterima, karena sesuai atau mendekati 1.
Menurut fatwa MUI kandungan etanol atau alcohol tidak diperbolehkan lebih dari 1 % dalam produk(makanan dam minuman), obat-obatan, kosmetik, obat tradisional dan produk biologi (Majelis Ulama Indonesia., 2009)
Gambar 1
Kromatografi Gas (GC)
1. Prinsip dasar kromatografi gas yaitu metode pemisahan dan deteksi senyawa yang bersifat termo-stabil (tahan panas) dan mudah menguap dalam suatu campura dengan menggunakan gas sebagai fase gerak (carrier / pembawa) yang mendorong campuran senyawa melewati fase diam(kolom) untuk dipisahkan dan diidentifikasi oleh detector sehingga meghasilkan kromatogram yang dibaca oleh pencatat (recorder) . Aplikasi kromatografi gas dalam bidang farmasi dan obat-obatan dapat digunakan dalam pengontrolan kualitas, analisa hasil-hasil baru dalam pengamatan metabolisme dalam zat-zatalir biologi dan analisis kandungan senyawa yang mudah menguap
2. Kromatografi gas dipilih untuk menganalisis sampel karena sampel yang akan dianalisis yaitu etanol memiliki sifat mudah menguap dan tahan pemanasan. Analisis sampel menggunakan kromatografi gas ditujukan untuk sampel yang mudah menguap dan tahan terhadap pemanasan (termostabil)
3. Praktikum ini dilakukan secara online. Oleh karena
itu, kami tidak mempraktikkan analisis kualitatif dan kuantitatif kandungan
alcohol dalam
sampel.
4. Praktikum ini dilakukan secara online. Oleh karena itu, kami tidak mempraktikkan teknik kuantifikasi standard internal
Astuti. N. P. W, dkk., 2018., VALIDASI METODE DALAM PENENTUANKADAR ETANOL PADA ARAK MENGGUNAKAN KROMATOGRAFI GAS DETEKTOR IONISASI NYALA., Jurnal kimia., 12(2):97-206
Lusiana. L., 2012., APPLICATION OF CALIBRATION CURVE, ACCURACY AND PRECISION CHART AS INTERNAL QUALITY CONTROL AT COD TESTING IN WASTEWATER. Biopropal Industri. 3(1):8
Majelis Ulama Indonesia., 2009., FATWA NOMOR 11 TAHUN 2009 TENTANG HUKUM ALKOHOL